ডালটনের পরমাণুবাদে বলা হয়েছিল,
(1) পরমাণু অবিভাজ্য অর্থাৎ পরমাণুকে আর ভাঙা যায় না।
(2) পরমাণু নিরেট অর্থাৎ পরমাণু একদম শক্ত ও এতে কোনও ফাঁকা জায়গা নেই।
(3) পরমাণু রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে।
কিন্তু বাস্তবে পরমাণু অবিভাজ্য নয়। একটি পরমাণুকে ভেঙে তিনটি মূল কণিকা পাওয়া যায়। (i) ইলেকট্রন (ii) প্রোটন ও (iii) নিউট্রন। এই তিনটি মূল কণিকার প্রকৃতি ও ধর্মও আলাদা। নীচে একটি তালিকার মাধ্যমে এই তিনটি কণিকার অবস্থান, প্রকৃতি, চরিত্র ও ভর দেখানো হল।
একটি পরমাণুর মূলত দুটি অংশ। (i) একটি নিউক্লিয়াস (ii) নিউক্লিয়াসের বাইরের ইলেকট্রনমহল।
নিউক্লিয়াস বা পরমাণুর কেন্দ্রক (Neucleus):
একটি পরমাণুর নিউক্লিয়াস হল সবথেকে নিরেট অংশ। এখানে ধনাত্বক আধানের প্রোটন কণা ও নিস্তড়িৎ নিউট্রন কণাগুলি একত্রে ঠাসাঠাসিভাবে অবস্থান করে। এবং এখানে েই সবথেকে ভারী কণা নিউট্রন ও প্রোটন কণাগুলি একত্রে অবস্থান করার ফলে এই নিউক্লিয়াসই হল পরমাণুর সবচেয়ে ভারী ও নিরেট অংশ।
নিউক্লিয়াসের বাইরের ইলেকট্রন মহল:
পরমাণুর এই নিরেট নিউক্লিয়াসকে কেন্দ্র করে ঋনাত্বক আধানের ইলেকট্রন কণাগুলি বিভিন্ন কক্ষপথে আবর্তন করতে থাকে। ঠিক সৌরজগতের গঠনে সূর্যকে কেন্দ্র করে যেমন বিভিন্ন গ্রহগুলি বিভিন্ন কক্ষপথে আবর্তন করে, এখানেও ঠিক সেইরকম এই নিউক্লিয়াসকে কেন্দ্র করে ঋনাত্বক আধানের ইলেকট্রন কণাগুলি বিভিন্ন কক্ষপথে আবর্তন করে। একটি পরমাণুর সামগ্রিক আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগন্য (কম)। তাই ডালটন বলেছিলেন, পরমাণুর পুরোটাই নিরেট, কিন্তু বাস্তবে দেখা যাচ্ছে পরমাণুর বেশিরভাগ স্থানই ফাঁকা।
তবে সৌরজগতের গঠনে আমরা দেখতে পাই, একটি কক্ষপথে কেবলমাত্র একটি গ্রহই আবর্তন করে কিন্তু এই পরমাণুর গঠনে একটি কক্ষপথে এক বা একাধিক ইলেকট্রন আবর্তন করতে পারে। পরমাণুর গঠনে নিউক্লিয়াসের পর প্রথম যে কক্ষপথটি থাকে তার নাম \(K\) কক্ষপথ, তারপরেরটি \(L\), \(M\), \(N\), ... ... এইভাবে নামকরণ করা হয়। এখানে এই কক্ষপথগুলিকে বলা হয় মুখ্য কোয়ান্টাম নম্বর (\(n\))।
এখানে,
\(n = 1\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(K\) কক্ষপথ।
\(n = 2\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(L\) কক্ষপথ।
\(n = 3\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(M\) কক্ষপথ।
\(n = 4\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(N\) কক্ষপথ।
\(n = 5\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(O\) কক্ষপথ।
\(n = 6\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(P\) কক্ষপথ।
এবং কোন্ কক্ষপথে কতগুলি করে ইলেকট্রন আবর্তন করবে তাও আবার নির্দিষ্ট। এক্ষেত্রে দুটি নির্দিষ্ট নিয়ম মেনে চলতে হয়।
প্রথম নিয়ম:
\(K\) কক্ষপথে সর্বাধিক থাকতে পারবে \(2\) টি ইলেকট্রন।
\(L\) কক্ষপথে সর্বাধিক থাকতে পারবে \(8\) টি ইলেকট্রন।
\(M\) কক্ষপথে সর্বাধিক থাকতে পারবে \(18\) টি ইলেকট্রন।
\(N\) কক্ষপথে সর্বাধিক থাকতে পারবে \(32\) টি ইলেকট্রন।
\(O\) কক্ষপথে সর্বাধিক থাকতে পারবে \(50\) টি ইলেকট্রন ইত্যাদি।
এখানে খুব ভালো করে মনে রাখতে হবে যে ওই ওই কক্ষপথে সর্বাধিক ইলেকট্রন সংখ্যা। অর্থাৎ সবচেয়ে বেশী থাকতে পারে ওই সংখ্যক ইলেকট্রন। কিন্তু তার থেকে কমও থাকতে পারে কিন্তু কোনও ভাবেই ওই নির্ধারিত সংখ্যার চেয়ে বেশী ইলেকট্রন থাকবে না।
দ্বিতীয় নিয়ম:
কোনও পরমাণুর সবথেকে যেটি বাইরের কক্ষপথ হবে, তাতে কখনোই কিন্তু \(8\) টির বেশী ইলেকট্রন থাকবে না। একেবারে শেষ কক্ষপথে একটিমাত্র ক্ষেত্রে \(8\) টি ইলেকট্ন থাকতে পারে। যদি \(8\) টি ইলেকট্রন থাকে তাহলে সেটি অবশ্যই একটি নিষ্ক্রিয় গ্যাস হবে। এই নিষ্ক্রিয় গ্যাসগুলি ছাড়া অন্য কোনও পরমাণুর কোনও ভাবেই \(8\) টি বা তার থেকে বেশী ইলেকট্রন থাকবে না। (যদিও একটি ব্যাতিক্রম আছে, হিলিয়াম পরমাণুর বাইরের কক্ষপথে মাত্র \(2\) টি ইলেকট্রন আছে, যদিও হিলিয়াম একটি নিষ্ক্রিয় গ্যাস)।
➤ তাহলে আমরা এখানে জানলাম যে, কোনও পরমাণু শুধুমাত্র তিনটি কণা দ্বারা গঠিত হয়, ইলেকট্রন, প্রোটন ও নিউট্রন। এবার পরমাণুগুলি আলাদা আলাদা হওয়ার কারণ হল, ওই পরমানুগুলির ভিতরে প্রোটন সংখ্যার বিভিন্নতা। বিভিন্ন পরমাণুতে তার নিউক্লিয়াসে বিভিন্ন সংখ্যক প্রোটন থাকে বলেই পরমাণুগুলি আলাদা আলাদা হয়। কিন্তু বর্তমানে মোট \(110\) টি মৌলিক পরমাণুর সবগুলোই তৈরি এই ইলেকট্রন, প্রোটন ও নিউট্রন কণা দিয়ে।
➤ আর একটি বিষয় মনে রাখা দরকার। আমরা পূর্বেই দেখলাম, পরমাণুর মধ্যে নিউক্লিয়াসের ভিতরে থাকে ধনাত্বক তড়িতের প্রোটন কণা এবং নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষপথে ঘুরে বেড়ায় ঋনাত্বক তড়িতের ইলেকট্রন কণিকা। তাহলে পরমাণুর ভিতরে এই তড়িতগ্রস্থ কণাগুলো থাকা সত্ত্বেও কোনও পরমাণু বা পদার্থে চার্জ বা বৈদ্যুতিক শক্ লাগে না কেন?
আসলে উপরের তালিকাতে দেখেছি, একটি প্রোটনে ঠিক যে পরিমান ধনাত্বক তড়িৎ থাকে, একটি ইলেকট্রনেও ঠিক সেই পরিমান ঋনাত্বক তড়িত থাকে। এবং কোনো পরমাণুর ভিতরে যতগুলো প্রোটন কণা থাকে, নিউক্লিয়াসের বাইরে ঠিক ততগুলি ইলেকট্রন কণা থাকে। তাই সামগ্রিকভাবে পরমাণুটিকে ভাবলে সেটি আসলে তড়িত নিরপেক্ষ হয়। প্রোটনের ধনাত্বক তড়িত, ইলেকট্রনের ঋনাত্বক তড়িতকে সম্পূর্ণভাবে প্রশমিত করে দেয়, তাই পরমাণু তড়িৎ নিরপেক্ষ বা নিস্তড়িৎ হয়।
পরমাণু বিষয়ক দুটি গুরুত্বপূর্ণ সংজ্ঞা (Two Important Definition):
পারমাণবিক সংখ্যা বা পরমাণু ক্রমাঙ্ক (Atomic Number):
কোনও পরমাণুর নিউক্লিয়াসের ভিতরে যতগুলি ধনাত্বক তড়িতের প্রোটন কণা থাকে, সেই সংখ্যাকে ওই মৌলের পরমাণুর পারমাণবিক সংখ্যা বা পরমাণু ক্রমাঙ্ক বলে। কোনো মৌলের পারমাণবিক সংখ্যাকে সর্বদা \(Z\) অক্ষর দিয়ে প্রকাশ করা হয়।
যেমন:
হাইড্রোজেন পরমাণুর নিউক্লিয়াসের ভিতরে \(1\) টি প্রোটন থাকে, তাই হাইড্রোজেনের পারমাণবিক সংখ্যা হল \(1\)। আবার ম্যাগনেশিয়াম পরমাণুর নিউক্লিয়াসের ভিতরে মোট \(12\) টি প্রোটন থাকে, তাই ম্যাগনেশিয়াম পরমাণুর পারমাণবিক সংখ্যা হল \(12\)।
ভরসংখ্যা (Mass Number):
কোনও পরমাণুর নিউক্লিয়াসের ভিতরে যতগুলি প্রোটন ও নিউট্রন কণা থাকে, তাদের মোট সমষ্টিকে ভরসংখ্যা বলে। কোনও মৌলের ভরসংখ্যাকে \(Z\) অক্ষর দ্বারা প্রকাশ করা হয়।
যেমন:
সোডিয়াম পরমাণুর নিউক্লিয়াসের ভিতরে মোট \(11\) টি প্রোটন ও \(12\) টি নিউট্রন থাকে, তাকে সোডিয়াম পরমাণুর ভরসংখ্যা হল \(23\)। আবার ক্যালশিয়াম পরমাণুর নিউক্লিয়াসের ভিতরে মোট \(20\) টি প্রোটন ও \(20\) টি নিউট্রন থাকে, তাই ক্যালশিয়াম পরমাণুর ভরসংখ্যা হল \(40\)।
এখানে প্রথম \(20\) টি পরমাণুর গঠন একটি বিস্তারিতভাবে ও তালিকার মাধ্যমে দেখানো হল। একটি পরমাণুর গঠন বর্ণনা করা বলতে বোঝায় তার কেন্দ্রে কয়টি প্রোটন ও কয়টি নিউট্রন ও নিউক্লিয়াসের বাইরে কোন কক্ষপথে কয়টি ইলেকট্রন কিভাবে আছে তা বিশেষভাবে জানা।
হাইড্রোজেন পরমাণু (\(H_1^1\)):
হাইড্রোজেন পরমাণুর নিউক্লিয়াসের মধ্যে একটি প্রোটন ও নিউক্লিয়াসের বাইরে একটি ইলেকট্রন আবর্তন করে।
হিলিয়াম পরমাণু (\(He_2^4\)):
হিলিয়াম পরমাণুর নিউক্লিয়াসের মধ্যে দুটি প্রোটন ও নিউক্লিয়াসের বাইরে দুটি ইলেকট্রন আবর্তন করে।
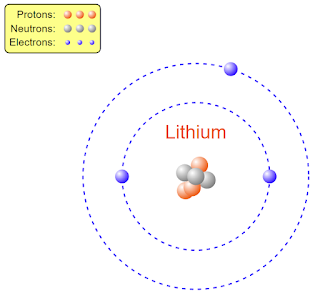
লিথিয়াম পরমাণু (\(Li_3^6\)):
লিথিয়াম পরমাণুর নিউক্লিয়াসের মধ্যে তিনটি প্রোটন ও নিউক্লিয়াসের বাইরে তিনটি ইলেকট্রন আবর্তন করে।
বেরিলিয়াম পরমাণু (\(Be_4^9\)):
বেরিলিয়াম পরমাণুর নিউক্লিয়াসের মধ্যে চারটি প্রোটন ও নিউক্লিয়াসের বাইরে চারটি ইলেকট্রন আবর্তন করে।
বোরন পরমাণু (\(B_5^{10}\)):
বোরন পরমাণুর নিউক্লিয়াসে মধ্যে পাঁচটি প্রোটন ও নিউক্লিয়াসের বাইরে পাঁচটি ইলেকট্রন আবর্তন করে।
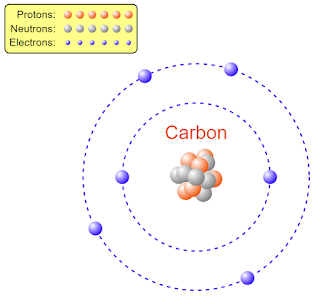
কার্বন পরমাণু (\(C_6^{12}\)):
কার্বন পরমাণুর নিউক্লিয়াসের মধ্যে মোট ছয়টি প্রোটন ও নিউক্লিয়াসের বাইরে ছয়টি ইলেকট্রন আবর্তন করে।
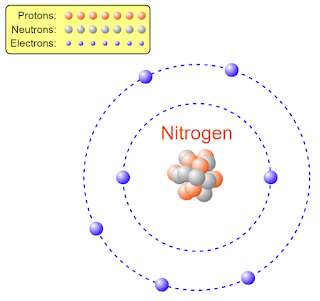
নাইট্রোেজেন পরমাণু (\(N_7^{14}\)):
নাইট্রোজেন পরমাণুর নিউক্লিয়াসের মধ্যে মোট সাতটি প্রোটন ও নিউক্লিয়াসের বাইরে সাতটি ইলেকট্রন আবর্তন করে।
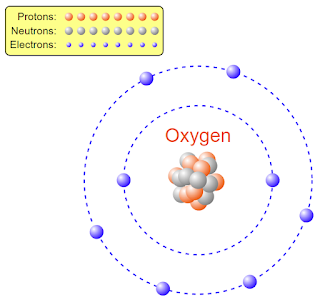
অক্সিজেন পরমাণু (\(O_8^{16}\)):
অক্সিজেন পরমাণুর নিউক্লিয়াসের মধ্যে মোট আটটি প্রোটন ও নিউক্লিয়াসের বাইরে আটটি ইলেকট্রন আবর্তন করে।
ফ্লোরিন পরমাণু (\(F_9^{19}\)):
ফ্লোরিন পরমাণুর নিউক্লিয়াসের মধ্যে মোট নয়টি প্রোটন ও নিউক্লিয়াসের বাইরে নয়টি ইলেকট্রন আবর্তন করে।
নিয়ন পরমাণু (\(Ne_{10}^{20}\)):
নিয়ন পরমাণুর নিউক্লিয়াসের মধ্যে মোট দশটি প্রোটন ও নিউক্লিয়াসের বাইরে দশটি ইলেকট্রন বিভিন্ন কক্ষপথে আবর্তন করে।
আয়নের ধারণা (Concept of Ions):
আমরা দেখলাম পরমাণু সাধারণভাবে নিস্তড়িৎ হয়, কারণ পরমাণুর নিউক্লিয়াসের ভিতরে যতগুলি ধনাত্বক তড়িতের প্রোটন কণা থাকে, ওই পরমাণুর নিউক্লিয়াসের বাইরে ঠিক ততগুলি ঋনাত্বক তড়িতের ইলেকট্রন কণা থাকে। এবং প্রোটন ও ইলেকট্রনের আধানের পরিমাণ একই হওয়ায় পরমাণু নিস্তড়িত হয়।
এই প্রোটন ও ইলেকট্রনের মধ্যে প্রোটনের অবস্থান পরমাণুর নিউক্লিয়াসের ভিতরে ও ইলেকট্রনের অবস্থান নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষপথে। তাই একটি পরমাণু থেকে কোনওভাবেই প্রোটন সহজে বেরিয়ে যেতে পারে না বা বাইরে থেকেও প্রোটন এসে নিউক্লিয়াসের ভিতরে প্রবেশ করতে পারে না।
কিন্তু পরমাণুর সবচেয়ে বাইরের কক্ষপথের ইলেকট্রনগুলি বিভিন্ন কারণে (শক্তি শোষন বা বর্জনে) বেরিয়ে যেতে পারে আবার অন্য কোনও পরমাণু থেকে চলেও আসতে পারে। তখন ওই পরমাণুতে প্রোটন ও ইলেকট্রন সংখ্যা আলাদা হয়ে যায়। এই প্রোটন ও ইলেকট্রন সংখ্যা আলাদা হলে আধানের পার্থক্যের জন্য ওই পরমাণুটি তড়িৎগ্রস্থ হয়ে পড়ে। তখন তাকে আর নিস্তড়িৎ পরমাণু বলা হয় না। তখন পরমাণুটি হয় তড়িৎগ্রস্থ। এই তড়িৎগ্রস্থ পরমাণুই হল আয়ন।
একটি নিস্তড়িৎ পরমাণুর প্রবণতা:
আমরা উপরের তালিকাতে দেখেছি, কোনও পরমাণুর বাইরের কক্ষপথটিতে \(8\) টি ইলেকট্রন হয়ে গেলেই, তার যোজ্যতা শূন্য হয়ে যায়। তবে ব্যাতিক্রম হয় কেবলমাত্র হিলিয়াম (\(He\)) পরমাণুর ক্ষেত্রে। হিলিয়াম পরমাণুর বাইরের কক্ষপথে (\(2\)) টি ইলেকট্রনেই নিষ্ক্রিয়তা লাভ করে এবং যোজ্যতা শূন্য হয়ে যায়। এখন এই মৌলগুলিকে নিষ্ক্রিয় মৌল বলা হয়।
নিষ্ক্রিয় মৌল অর্থাৎ যে রাসায়নিক ভাবে নিষ্ক্রিয় চরিত্রের হয়ে যায়। অর্থাৎ তখন এই মৌলগুলি আর রাসায়নিক বিক্রিয়ায় অংশগ্রহন করে না। এইরকম কয়েকটি মৌল হল:
হিলিয়াম (He): K(2)
নিয়ন (Ne): K(2), L(8)
আর্গন (Ar): K(2), L(8), M(8)
ক্রিপটন (Kr): K(2), L(8), M(18), N(8)
জেনন (Xe): K(2), L(8), M(18), N(18), O(8)
রেডন (Rn): K(2), L(8), M(18), N(32), O(18), P(8)
এই নিষ্ক্রিয় মৌলগুলি বাদে যতগুলি মৌল আছে, সবগুলিরই সবচেয়ে বাইরের কক্ষের ইলেকট্রন সংখ্যা \(8\) হয় না। এদের বাইরের কক্ষের ইলেকট্রন সংখ্যা হয় \(1,2,3,4,5,6,7\) । পরমাণুগুলির এই সক্রিয়তার মূলকারণ হল এই বাইরের কক্ষে থাকা ইলেকট্রনগুলি। এখন এই পরমাণুগুলি তাদের সর্বঃবহিস্থ এক বা একাধিক ইলেকট্রন গ্রহণ বা বর্জনের মাধ্যমে, পরমাণুটি নিষ্ক্রিয় গ্যাসের ইলেকট্রন কাঠামো লাভ করতে চায়।
যে সমস্ত পরমাণুগুলির বাইরের কক্ষপথের ইলেকট্রন সংখ্যা \(1\), \(2\) বা, \(3\) হয়, তারা সাধারণত ইলেকট্রন বর্জনের মাধ্যমে খুব সহজেই তার বাইরের কক্ষের ইলেকট্রন কাঠামোতে অষ্টকপূর্তি করে এবং নিকটতম নিষ্ক্রিয় গ্যাসের ইলেকট্রন কাঠামো লাভ করে। এই অবস্থায় পরমাণুটির নিউক্লিয়াসের ভিতরে প্রোটন সংখ্যার তুলনায়, ইলেকট্রন সংখ্যা কম হয়। তখন এই পরমাণু ধনাত্বক তড়িতগ্রস্থ হয়ে পড়ে। কিন্তু রাসায়নিক ভাবে নিষ্ক্রিয় হয়।
আবার যে সমস্ত পরমাণুগুলির বাইরের কক্ষপথের ইলেকট্রন সংখ্যা \(5\), \(6\) বা, \(7\) হয়, তারা সাধারণত বাইরে থেকে ইলেকট্রন গ্রহনের মাধ্যমে খুব সহজেই তার বাইরের কক্ষের ইলেকট্রন কাঠামোতে অষ্টকপূর্তি করে এবং নিকটতম নিষ্ক্রিয় গ্যাসের ইলেকট্রন কাঠামো লাভ করে।
যেমন:
এখানে দেখা গেল, যে সমস্ত পরমাণুগুলির বাইরের কক্ষের ইলেকট্রন সংখ্যা \(1\), \(2\) বা \(3\) হয়, তারা সবসময় বাইরের কক্ষ থেকে ইলেকট্রনকে ত্যাগ করে এবং ইলেকট্রন ত্যাগ করলেই তা সর্বদা ধনাত্বক আয়নে পরিণত হয়। এদের ক্যাটায়ন বলে। এবং এরা সবসময় ধাতু হয়। এই ধাতুরাই সর্বদা ইলেকট্রন ত্যাগ করে ক্যাটায়নে পরিণত হয়।
আবার যে সমস্ত পরমাণুগুলির বাইরের কক্ষের ইলেকট্রন সংখ্যা \(5\), \(6\) বা \(7\) হয়, তারা সবসময় বাইরের কক্ষে, বাইরে থেকে ইলেকট্রন গ্রহণ করে এবং ইলেকট্রন গ্রহণ করলেই তা সর্বদা ঋনাত্বক আয়নে পরিণত হয়। এদের অ্যানায়ন বলে। এবং এরা সবসময় অধাতু হয়। এই অধাতুরাই সর্বদা ইলেকট্রন গ্রহণ করে অ্যানায়নে পরিণত হয়।
আয়ন (Ions):
ধনাত্বক বা ঋনাত্বক তড়িৎগ্রস্থ পরমাণুকে আয়ন বলে।
যেমন: \(N{a^ + }\), \(C{a^{ + + }}\), \(C{l^ - }\), \({S^ = }\) ইত্যাদি।
ক্যাটায়ন (Cation):
কোনও পরমাণুর সবচেয়ে বাইরের কক্ষপথ থেকে ইলেকট্রন বর্জনের ফলে সৃষ্ট ধনাত্বক তড়িৎগ্রস্থ পরমাণু বা আয়নকে ক্যাটায়ন বলে।
যেমন: \(N{a^ + }\), \(C{a^{ + + }}\) ইত্যাদি
অ্যানায়ন (Anion):
কোনও পরমাণুর সবচেয়ে বাইরের কক্ষপথে ইলেকট্রন গ্রহণের ফলে সৃষ্ট ঋনাত্বক তড়িৎগ্রস্থ পরমাণু বা আয়নকে অ্যানায়ন বলে।
যেমন: \(C{l^ - }\), \({S^ = }\) ইত্যাদি।
নিম্নে কয়েকটি আয়ন তৈরির কৌশলের উদাহরন দেওয়া হল:
(1) \(H - 1e \to {H^ + }\)
(2) \(H + 1e \to {H^ - }\)
(3) \(Li - 1e \to L{i^ + }\)
(4) \(Be - 2e \to B{e^{ + + }}\)
(5) \(B - 3e \to {B^{ + + + }}\)
(6) \(N + 3e \to {N^{ - - - }}\)
(7) \(O + 2e \to {O^{ - - }}\)
(8) \(F + 1e \to {F^ - }\)
(9) \(Na - 1e \to N{a^ + }\)
(10) \(Mg - 2e \to M{g^{ + + }}\)
(11) \(Al - 3e \to A{l^{ + + + }}\)
(12) \(P + 3e \to {P^{ - - - }}\)
(13) \(S + 2e \to {S^{ - - }}\)
(14) \(Cl + 1e \to C{l^ - }\)
(15) \(K - 1e \to {K^ + }\)
(16) \(Ca - 2e \to C{a^{ + + }}\)
Atom & Molecule Part: 1
Atom & Molecule Part: 2
Atom & Molecule Part: 3
Atom & Molecule Part: 4
Atom & Molecule Part: 5
Atom & Molecule Part: 6
(1) পরমাণু অবিভাজ্য অর্থাৎ পরমাণুকে আর ভাঙা যায় না।
(2) পরমাণু নিরেট অর্থাৎ পরমাণু একদম শক্ত ও এতে কোনও ফাঁকা জায়গা নেই।
(3) পরমাণু রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে।
কিন্তু বাস্তবে পরমাণু অবিভাজ্য নয়। একটি পরমাণুকে ভেঙে তিনটি মূল কণিকা পাওয়া যায়। (i) ইলেকট্রন (ii) প্রোটন ও (iii) নিউট্রন। এই তিনটি মূল কণিকার প্রকৃতি ও ধর্মও আলাদা। নীচে একটি তালিকার মাধ্যমে এই তিনটি কণিকার অবস্থান, প্রকৃতি, চরিত্র ও ভর দেখানো হল।
| ইলেকট্রন | এর আধান বা চার্জ ঋনাত্বক | এর আধানের পরিমাণ \(1.602 \times {10^{ - 19}}C\) | এর ভর \(9.1 \times {10^{ - 31}}kg\)। এই ইলেকট্রন কণিকার ভর সবচেয়ে কম। | এটি পরমাণুর নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষপথে ঘুরে বেড়ায়। |
| প্রোটন | এর আধান বা চার্জ ধনাত্বক | এর আধানের পরিমাণ \(1.602 \times {10^{ - 19}}C\) | এর ভর প্রায় \(1.672 \times {10^{ - 27}}kg\) | এটি পরমাণুর নিউক্লিয়াসের ভিতরে অবস্থিত। |
| নিউট্রন | এর কোনো আধান বা চার্জ নেই। নিস্তড়িৎ কণিকা | এটি নিস্তড়িৎ কণিকা | এর ভর প্রায় \(1.675 \times {10^{ - 27}}kg\)। এই প্রোটন কণিকার ভর সবচেয়ে বেশী। | এটি পরমাণুর নিউক্লিয়াসের ভিতরে অবস্থিত। |
একটি পরমাণুর মূলত দুটি অংশ। (i) একটি নিউক্লিয়াস (ii) নিউক্লিয়াসের বাইরের ইলেকট্রনমহল।
নিউক্লিয়াস বা পরমাণুর কেন্দ্রক (Neucleus):
একটি পরমাণুর নিউক্লিয়াস হল সবথেকে নিরেট অংশ। এখানে ধনাত্বক আধানের প্রোটন কণা ও নিস্তড়িৎ নিউট্রন কণাগুলি একত্রে ঠাসাঠাসিভাবে অবস্থান করে। এবং এখানে েই সবথেকে ভারী কণা নিউট্রন ও প্রোটন কণাগুলি একত্রে অবস্থান করার ফলে এই নিউক্লিয়াসই হল পরমাণুর সবচেয়ে ভারী ও নিরেট অংশ।
নিউক্লিয়াসের বাইরের ইলেকট্রন মহল:
পরমাণুর এই নিরেট নিউক্লিয়াসকে কেন্দ্র করে ঋনাত্বক আধানের ইলেকট্রন কণাগুলি বিভিন্ন কক্ষপথে আবর্তন করতে থাকে। ঠিক সৌরজগতের গঠনে সূর্যকে কেন্দ্র করে যেমন বিভিন্ন গ্রহগুলি বিভিন্ন কক্ষপথে আবর্তন করে, এখানেও ঠিক সেইরকম এই নিউক্লিয়াসকে কেন্দ্র করে ঋনাত্বক আধানের ইলেকট্রন কণাগুলি বিভিন্ন কক্ষপথে আবর্তন করে। একটি পরমাণুর সামগ্রিক আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগন্য (কম)। তাই ডালটন বলেছিলেন, পরমাণুর পুরোটাই নিরেট, কিন্তু বাস্তবে দেখা যাচ্ছে পরমাণুর বেশিরভাগ স্থানই ফাঁকা।
তবে সৌরজগতের গঠনে আমরা দেখতে পাই, একটি কক্ষপথে কেবলমাত্র একটি গ্রহই আবর্তন করে কিন্তু এই পরমাণুর গঠনে একটি কক্ষপথে এক বা একাধিক ইলেকট্রন আবর্তন করতে পারে। পরমাণুর গঠনে নিউক্লিয়াসের পর প্রথম যে কক্ষপথটি থাকে তার নাম \(K\) কক্ষপথ, তারপরেরটি \(L\), \(M\), \(N\), ... ... এইভাবে নামকরণ করা হয়। এখানে এই কক্ষপথগুলিকে বলা হয় মুখ্য কোয়ান্টাম নম্বর (\(n\))।
এখানে,
\(n = 1\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(K\) কক্ষপথ।
\(n = 2\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(L\) কক্ষপথ।
\(n = 3\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(M\) কক্ষপথ।
\(n = 4\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(N\) কক্ষপথ।
\(n = 5\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(O\) কক্ষপথ।
\(n = 6\) হলে কক্ষপথটি হল, প্রথম কক্ষপথ এবং এর নাম \(P\) কক্ষপথ।
এবং কোন্ কক্ষপথে কতগুলি করে ইলেকট্রন আবর্তন করবে তাও আবার নির্দিষ্ট। এক্ষেত্রে দুটি নির্দিষ্ট নিয়ম মেনে চলতে হয়।
প্রথম নিয়ম:
\(K\) কক্ষপথে সর্বাধিক থাকতে পারবে \(2\) টি ইলেকট্রন।
\(L\) কক্ষপথে সর্বাধিক থাকতে পারবে \(8\) টি ইলেকট্রন।
\(M\) কক্ষপথে সর্বাধিক থাকতে পারবে \(18\) টি ইলেকট্রন।
\(N\) কক্ষপথে সর্বাধিক থাকতে পারবে \(32\) টি ইলেকট্রন।
\(O\) কক্ষপথে সর্বাধিক থাকতে পারবে \(50\) টি ইলেকট্রন ইত্যাদি।
এখানে খুব ভালো করে মনে রাখতে হবে যে ওই ওই কক্ষপথে সর্বাধিক ইলেকট্রন সংখ্যা। অর্থাৎ সবচেয়ে বেশী থাকতে পারে ওই সংখ্যক ইলেকট্রন। কিন্তু তার থেকে কমও থাকতে পারে কিন্তু কোনও ভাবেই ওই নির্ধারিত সংখ্যার চেয়ে বেশী ইলেকট্রন থাকবে না।
দ্বিতীয় নিয়ম:
কোনও পরমাণুর সবথেকে যেটি বাইরের কক্ষপথ হবে, তাতে কখনোই কিন্তু \(8\) টির বেশী ইলেকট্রন থাকবে না। একেবারে শেষ কক্ষপথে একটিমাত্র ক্ষেত্রে \(8\) টি ইলেকট্ন থাকতে পারে। যদি \(8\) টি ইলেকট্রন থাকে তাহলে সেটি অবশ্যই একটি নিষ্ক্রিয় গ্যাস হবে। এই নিষ্ক্রিয় গ্যাসগুলি ছাড়া অন্য কোনও পরমাণুর কোনও ভাবেই \(8\) টি বা তার থেকে বেশী ইলেকট্রন থাকবে না। (যদিও একটি ব্যাতিক্রম আছে, হিলিয়াম পরমাণুর বাইরের কক্ষপথে মাত্র \(2\) টি ইলেকট্রন আছে, যদিও হিলিয়াম একটি নিষ্ক্রিয় গ্যাস)।
➤ তাহলে আমরা এখানে জানলাম যে, কোনও পরমাণু শুধুমাত্র তিনটি কণা দ্বারা গঠিত হয়, ইলেকট্রন, প্রোটন ও নিউট্রন। এবার পরমাণুগুলি আলাদা আলাদা হওয়ার কারণ হল, ওই পরমানুগুলির ভিতরে প্রোটন সংখ্যার বিভিন্নতা। বিভিন্ন পরমাণুতে তার নিউক্লিয়াসে বিভিন্ন সংখ্যক প্রোটন থাকে বলেই পরমাণুগুলি আলাদা আলাদা হয়। কিন্তু বর্তমানে মোট \(110\) টি মৌলিক পরমাণুর সবগুলোই তৈরি এই ইলেকট্রন, প্রোটন ও নিউট্রন কণা দিয়ে।
➤ আর একটি বিষয় মনে রাখা দরকার। আমরা পূর্বেই দেখলাম, পরমাণুর মধ্যে নিউক্লিয়াসের ভিতরে থাকে ধনাত্বক তড়িতের প্রোটন কণা এবং নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষপথে ঘুরে বেড়ায় ঋনাত্বক তড়িতের ইলেকট্রন কণিকা। তাহলে পরমাণুর ভিতরে এই তড়িতগ্রস্থ কণাগুলো থাকা সত্ত্বেও কোনও পরমাণু বা পদার্থে চার্জ বা বৈদ্যুতিক শক্ লাগে না কেন?
আসলে উপরের তালিকাতে দেখেছি, একটি প্রোটনে ঠিক যে পরিমান ধনাত্বক তড়িৎ থাকে, একটি ইলেকট্রনেও ঠিক সেই পরিমান ঋনাত্বক তড়িত থাকে। এবং কোনো পরমাণুর ভিতরে যতগুলো প্রোটন কণা থাকে, নিউক্লিয়াসের বাইরে ঠিক ততগুলি ইলেকট্রন কণা থাকে। তাই সামগ্রিকভাবে পরমাণুটিকে ভাবলে সেটি আসলে তড়িত নিরপেক্ষ হয়। প্রোটনের ধনাত্বক তড়িত, ইলেকট্রনের ঋনাত্বক তড়িতকে সম্পূর্ণভাবে প্রশমিত করে দেয়, তাই পরমাণু তড়িৎ নিরপেক্ষ বা নিস্তড়িৎ হয়।
পরমাণু বিষয়ক দুটি গুরুত্বপূর্ণ সংজ্ঞা (Two Important Definition):
পারমাণবিক সংখ্যা বা পরমাণু ক্রমাঙ্ক (Atomic Number):
কোনও পরমাণুর নিউক্লিয়াসের ভিতরে যতগুলি ধনাত্বক তড়িতের প্রোটন কণা থাকে, সেই সংখ্যাকে ওই মৌলের পরমাণুর পারমাণবিক সংখ্যা বা পরমাণু ক্রমাঙ্ক বলে। কোনো মৌলের পারমাণবিক সংখ্যাকে সর্বদা \(Z\) অক্ষর দিয়ে প্রকাশ করা হয়।
যেমন:
হাইড্রোজেন পরমাণুর নিউক্লিয়াসের ভিতরে \(1\) টি প্রোটন থাকে, তাই হাইড্রোজেনের পারমাণবিক সংখ্যা হল \(1\)। আবার ম্যাগনেশিয়াম পরমাণুর নিউক্লিয়াসের ভিতরে মোট \(12\) টি প্রোটন থাকে, তাই ম্যাগনেশিয়াম পরমাণুর পারমাণবিক সংখ্যা হল \(12\)।
ভরসংখ্যা (Mass Number):
কোনও পরমাণুর নিউক্লিয়াসের ভিতরে যতগুলি প্রোটন ও নিউট্রন কণা থাকে, তাদের মোট সমষ্টিকে ভরসংখ্যা বলে। কোনও মৌলের ভরসংখ্যাকে \(Z\) অক্ষর দ্বারা প্রকাশ করা হয়।
যেমন:
সোডিয়াম পরমাণুর নিউক্লিয়াসের ভিতরে মোট \(11\) টি প্রোটন ও \(12\) টি নিউট্রন থাকে, তাকে সোডিয়াম পরমাণুর ভরসংখ্যা হল \(23\)। আবার ক্যালশিয়াম পরমাণুর নিউক্লিয়াসের ভিতরে মোট \(20\) টি প্রোটন ও \(20\) টি নিউট্রন থাকে, তাই ক্যালশিয়াম পরমাণুর ভরসংখ্যা হল \(40\)।
এখানে প্রথম \(20\) টি পরমাণুর গঠন একটি বিস্তারিতভাবে ও তালিকার মাধ্যমে দেখানো হল। একটি পরমাণুর গঠন বর্ণনা করা বলতে বোঝায় তার কেন্দ্রে কয়টি প্রোটন ও কয়টি নিউট্রন ও নিউক্লিয়াসের বাইরে কোন কক্ষপথে কয়টি ইলেকট্রন কিভাবে আছে তা বিশেষভাবে জানা।
হাইড্রোজেন পরমাণু (\(H_1^1\)):
হাইড্রোজেন পরমাণুর নিউক্লিয়াসের মধ্যে একটি প্রোটন ও নিউক্লিয়াসের বাইরে একটি ইলেকট্রন আবর্তন করে।
হিলিয়াম পরমাণু (\(He_2^4\)):
হিলিয়াম পরমাণুর নিউক্লিয়াসের মধ্যে দুটি প্রোটন ও নিউক্লিয়াসের বাইরে দুটি ইলেকট্রন আবর্তন করে।
লিথিয়াম পরমাণু (\(Li_3^6\)):
লিথিয়াম পরমাণুর নিউক্লিয়াসের মধ্যে তিনটি প্রোটন ও নিউক্লিয়াসের বাইরে তিনটি ইলেকট্রন আবর্তন করে।
বেরিলিয়াম পরমাণু (\(Be_4^9\)):
বেরিলিয়াম পরমাণুর নিউক্লিয়াসের মধ্যে চারটি প্রোটন ও নিউক্লিয়াসের বাইরে চারটি ইলেকট্রন আবর্তন করে।
বোরন পরমাণু (\(B_5^{10}\)):
বোরন পরমাণুর নিউক্লিয়াসে মধ্যে পাঁচটি প্রোটন ও নিউক্লিয়াসের বাইরে পাঁচটি ইলেকট্রন আবর্তন করে।
কার্বন পরমাণু (\(C_6^{12}\)):
কার্বন পরমাণুর নিউক্লিয়াসের মধ্যে মোট ছয়টি প্রোটন ও নিউক্লিয়াসের বাইরে ছয়টি ইলেকট্রন আবর্তন করে।
নাইট্রোেজেন পরমাণু (\(N_7^{14}\)):
নাইট্রোজেন পরমাণুর নিউক্লিয়াসের মধ্যে মোট সাতটি প্রোটন ও নিউক্লিয়াসের বাইরে সাতটি ইলেকট্রন আবর্তন করে।
অক্সিজেন পরমাণু (\(O_8^{16}\)):
অক্সিজেন পরমাণুর নিউক্লিয়াসের মধ্যে মোট আটটি প্রোটন ও নিউক্লিয়াসের বাইরে আটটি ইলেকট্রন আবর্তন করে।
ফ্লোরিন পরমাণু (\(F_9^{19}\)):
ফ্লোরিন পরমাণুর নিউক্লিয়াসের মধ্যে মোট নয়টি প্রোটন ও নিউক্লিয়াসের বাইরে নয়টি ইলেকট্রন আবর্তন করে।
নিয়ন পরমাণু (\(Ne_{10}^{20}\)):
নিয়ন পরমাণুর নিউক্লিয়াসের মধ্যে মোট দশটি প্রোটন ও নিউক্লিয়াসের বাইরে দশটি ইলেকট্রন বিভিন্ন কক্ষপথে আবর্তন করে।
| পারমাণবিক সংখ্যা | পরমাণুর নাম | চিহ্ন | \(K\left( 2 \right)\) | \(L\left( 8 \right)\) | \(M\left( 18 \right)\) | \(N\left( 32 \right)\) | যোজ্যতা | চরিত্র |
| \(1\) | হাইড্রোজেন | \(H\) | \(1\) | - | - | - | \(1\) | অধাতু |
| \(2\) | হিলিয়াম | \(He\) | \(2\) | - | - | - | \(0\) | নিষ্ক্রিয় গ্যাস |
| \(3\) | লিথিয়াম | \(Li\) | \(2\) | \(1\) | - | - | \(1\) | ধাতু |
| \(4\) | বেরিলিয়াম | \(Be\) | \(2\) | \(2\) | - | - | \(2\) | ধাতু |
| \(5\) | বোরন | \(B\) | \(2\) | \(3\) | - | - | \(3\) | ধাতু |
| \(6\) | কার্বন | \(C\) | \(2\) | \(4\) | - | - | \(\left( {8 - 4} \right) = 4\) | অধাতু |
| \(7\) | নাইট্রোজেন | \(N\) | \(2\) | \(5\) | - | - | \(\left( {8 - 5} \right) = 3\) | অধাতু |
| \(8\) | অক্সিজেন | \(O\) | \(2\) | \(6\) | - | - | \(\left( {8 - 6} \right) = 2\) | অধাতু |
| \(9\) | ফ্লোরিন | \(F\) | \(2\) | \(7\) | - | - | \(\left( {8 - 7} \right) = 1\) | অধাতু |
| \(10\) | নিয়ন | \(Ne\) | \(2\) | \(8\) | - | - | \(\left( {8 - 8} \right) = 0\) | নিষ্ক্রিয় গ্যাস |
| \(11\) | সোডিয়াম | \(Na\) | \(2\) | \(8\) | \(1\) | - | \(1\) | ধাতু |
| \(12\) | ম্যাগনেশিয়াম | \(Mg\) | \(2\) | \(8\) | \(2\) | - | \(2\) | ধাতু |
| \(13\) | অ্যালুমিনিয়াম | \(Al\) | \(2\) | \(8\) | \(3\) | - | \(3\) | ধাতু |
| \(14\) | সিলিকন | \(Si\) | \(2\) | \(8\) | \(4\) | - | \(\left( {8 - 4} \right) = 4\) | - |
| \(15\) | ফসফরাস | \(P\) | \(2\) | \(8\) | \(5\) | - | \(\left( {8 - 5} \right) = 3\) | অধাতু |
| \(16\) | সালফার | \(S\) | \(2\) | \(8\) | \(6\) | - | \(\left( {8 - 6} \right) = 2\) | অধাতু |
| \(17\) | ক্লোরিন | \(Cl\) | \(2\) | \(8\) | \(7\) | - | \(\left( {8 - 7} \right) = 1\) | অধাতু |
| \(18\) | আর্গন | \(Ar\) | \(2\) | \(8\) | \(8\) | - | \(\left( {8 - 8} \right) = 0\) | নিষ্ক্রিয় গ্যাস |
| \(19\) | পটাশিয়াম | \(K\) | \(2\) | \(8\) | \(8\) | \(1\) | \(1\) | ধাতু |
| \(20\) | ক্যালশিয়াম | \(Ca\) | \(2\) | \(8\) | \(8\) | \(2\) | \(2\) | ধাতু |
আয়নের ধারণা (Concept of Ions):
আমরা দেখলাম পরমাণু সাধারণভাবে নিস্তড়িৎ হয়, কারণ পরমাণুর নিউক্লিয়াসের ভিতরে যতগুলি ধনাত্বক তড়িতের প্রোটন কণা থাকে, ওই পরমাণুর নিউক্লিয়াসের বাইরে ঠিক ততগুলি ঋনাত্বক তড়িতের ইলেকট্রন কণা থাকে। এবং প্রোটন ও ইলেকট্রনের আধানের পরিমাণ একই হওয়ায় পরমাণু নিস্তড়িত হয়।
এই প্রোটন ও ইলেকট্রনের মধ্যে প্রোটনের অবস্থান পরমাণুর নিউক্লিয়াসের ভিতরে ও ইলেকট্রনের অবস্থান নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষপথে। তাই একটি পরমাণু থেকে কোনওভাবেই প্রোটন সহজে বেরিয়ে যেতে পারে না বা বাইরে থেকেও প্রোটন এসে নিউক্লিয়াসের ভিতরে প্রবেশ করতে পারে না।
কিন্তু পরমাণুর সবচেয়ে বাইরের কক্ষপথের ইলেকট্রনগুলি বিভিন্ন কারণে (শক্তি শোষন বা বর্জনে) বেরিয়ে যেতে পারে আবার অন্য কোনও পরমাণু থেকে চলেও আসতে পারে। তখন ওই পরমাণুতে প্রোটন ও ইলেকট্রন সংখ্যা আলাদা হয়ে যায়। এই প্রোটন ও ইলেকট্রন সংখ্যা আলাদা হলে আধানের পার্থক্যের জন্য ওই পরমাণুটি তড়িৎগ্রস্থ হয়ে পড়ে। তখন তাকে আর নিস্তড়িৎ পরমাণু বলা হয় না। তখন পরমাণুটি হয় তড়িৎগ্রস্থ। এই তড়িৎগ্রস্থ পরমাণুই হল আয়ন।
একটি নিস্তড়িৎ পরমাণুর প্রবণতা:
আমরা উপরের তালিকাতে দেখেছি, কোনও পরমাণুর বাইরের কক্ষপথটিতে \(8\) টি ইলেকট্রন হয়ে গেলেই, তার যোজ্যতা শূন্য হয়ে যায়। তবে ব্যাতিক্রম হয় কেবলমাত্র হিলিয়াম (\(He\)) পরমাণুর ক্ষেত্রে। হিলিয়াম পরমাণুর বাইরের কক্ষপথে (\(2\)) টি ইলেকট্রনেই নিষ্ক্রিয়তা লাভ করে এবং যোজ্যতা শূন্য হয়ে যায়। এখন এই মৌলগুলিকে নিষ্ক্রিয় মৌল বলা হয়।
নিষ্ক্রিয় মৌল অর্থাৎ যে রাসায়নিক ভাবে নিষ্ক্রিয় চরিত্রের হয়ে যায়। অর্থাৎ তখন এই মৌলগুলি আর রাসায়নিক বিক্রিয়ায় অংশগ্রহন করে না। এইরকম কয়েকটি মৌল হল:
হিলিয়াম (He): K(2)
নিয়ন (Ne): K(2), L(8)
আর্গন (Ar): K(2), L(8), M(8)
ক্রিপটন (Kr): K(2), L(8), M(18), N(8)
জেনন (Xe): K(2), L(8), M(18), N(18), O(8)
রেডন (Rn): K(2), L(8), M(18), N(32), O(18), P(8)
এই নিষ্ক্রিয় মৌলগুলি বাদে যতগুলি মৌল আছে, সবগুলিরই সবচেয়ে বাইরের কক্ষের ইলেকট্রন সংখ্যা \(8\) হয় না। এদের বাইরের কক্ষের ইলেকট্রন সংখ্যা হয় \(1,2,3,4,5,6,7\) । পরমাণুগুলির এই সক্রিয়তার মূলকারণ হল এই বাইরের কক্ষে থাকা ইলেকট্রনগুলি। এখন এই পরমাণুগুলি তাদের সর্বঃবহিস্থ এক বা একাধিক ইলেকট্রন গ্রহণ বা বর্জনের মাধ্যমে, পরমাণুটি নিষ্ক্রিয় গ্যাসের ইলেকট্রন কাঠামো লাভ করতে চায়।
যে সমস্ত পরমাণুগুলির বাইরের কক্ষপথের ইলেকট্রন সংখ্যা \(1\), \(2\) বা, \(3\) হয়, তারা সাধারণত ইলেকট্রন বর্জনের মাধ্যমে খুব সহজেই তার বাইরের কক্ষের ইলেকট্রন কাঠামোতে অষ্টকপূর্তি করে এবং নিকটতম নিষ্ক্রিয় গ্যাসের ইলেকট্রন কাঠামো লাভ করে। এই অবস্থায় পরমাণুটির নিউক্লিয়াসের ভিতরে প্রোটন সংখ্যার তুলনায়, ইলেকট্রন সংখ্যা কম হয়। তখন এই পরমাণু ধনাত্বক তড়িতগ্রস্থ হয়ে পড়ে। কিন্তু রাসায়নিক ভাবে নিষ্ক্রিয় হয়।
আবার যে সমস্ত পরমাণুগুলির বাইরের কক্ষপথের ইলেকট্রন সংখ্যা \(5\), \(6\) বা, \(7\) হয়, তারা সাধারণত বাইরে থেকে ইলেকট্রন গ্রহনের মাধ্যমে খুব সহজেই তার বাইরের কক্ষের ইলেকট্রন কাঠামোতে অষ্টকপূর্তি করে এবং নিকটতম নিষ্ক্রিয় গ্যাসের ইলেকট্রন কাঠামো লাভ করে।
যেমন:
| \(Na\left( {2,8,1} \right)\) | \( - 1e\) | \(N{a^{ + 1}}\left( {2,8} \right)\) | নিয়নের ইলেকট্রন কাঠামো লাভ করলো এবং নিষ্ক্রিয় চরিত্র অর্জন করে ক্যাটায়নে পরিণত হল। |
| \(Mg\left( {2,8,2} \right)\) | \( - 2e\) | \(M{g^{ + 2}}\left( {2,8} \right)\) | নিয়নের ইলেকট্রন কাঠামো লাভ করলো এবং নিষ্ক্রিয় চরিত্র অর্জন করে ক্যাটায়নে পরিণত হল। |
| \(Al\left( {2,8,3} \right)\) | \( - 3e\) | \(A{l^{ + 3}}\left( {2,8} \right)\) | নিয়নের ইলেকট্রন কাঠামো লাভ করলো এবং নিষ্ক্রিয় চরিত্র অর্জন করে ক্যাটায়নে পরিণত হল। |
| \(P\left( {2,8,5} \right)\) | \( + 3e\) | \({P^{ - 3}}\left( {2,8,8} \right)\) | আর্গনের ইলেকট্রন কাঠামো লাভ করলো এবং নিষ্ক্রিয় চরিত্র অর্জন করে অ্যানায়নে পরিণত হল। |
| \(S\left( {2,8,6} \right)\) | \( + 2e\) | \({S^{ - 2}}\left( {2,8,8} \right)\) | আর্গনের ইলেকট্রন কাঠামো লাভ করলো এবং নিষ্ক্রিয় চরিত্র অর্জন করে অ্যানায়নে পরিণত হল। |
| \(Cl\left( {2,8,7} \right)\) | \( + 1e\) | \(C{l^{ - 1}}\left( {2,8,8} \right)\) | আর্গনের ইলেকট্রন কাঠামো লাভ করলো এবং নিষ্ক্রিয় চরিত্র অর্জন করে অ্যানায়নে পরিণত হল। |
এখানে দেখা গেল, যে সমস্ত পরমাণুগুলির বাইরের কক্ষের ইলেকট্রন সংখ্যা \(1\), \(2\) বা \(3\) হয়, তারা সবসময় বাইরের কক্ষ থেকে ইলেকট্রনকে ত্যাগ করে এবং ইলেকট্রন ত্যাগ করলেই তা সর্বদা ধনাত্বক আয়নে পরিণত হয়। এদের ক্যাটায়ন বলে। এবং এরা সবসময় ধাতু হয়। এই ধাতুরাই সর্বদা ইলেকট্রন ত্যাগ করে ক্যাটায়নে পরিণত হয়।
আবার যে সমস্ত পরমাণুগুলির বাইরের কক্ষের ইলেকট্রন সংখ্যা \(5\), \(6\) বা \(7\) হয়, তারা সবসময় বাইরের কক্ষে, বাইরে থেকে ইলেকট্রন গ্রহণ করে এবং ইলেকট্রন গ্রহণ করলেই তা সর্বদা ঋনাত্বক আয়নে পরিণত হয়। এদের অ্যানায়ন বলে। এবং এরা সবসময় অধাতু হয়। এই অধাতুরাই সর্বদা ইলেকট্রন গ্রহণ করে অ্যানায়নে পরিণত হয়।
আয়ন (Ions):
ধনাত্বক বা ঋনাত্বক তড়িৎগ্রস্থ পরমাণুকে আয়ন বলে।
যেমন: \(N{a^ + }\), \(C{a^{ + + }}\), \(C{l^ - }\), \({S^ = }\) ইত্যাদি।
ক্যাটায়ন (Cation):
কোনও পরমাণুর সবচেয়ে বাইরের কক্ষপথ থেকে ইলেকট্রন বর্জনের ফলে সৃষ্ট ধনাত্বক তড়িৎগ্রস্থ পরমাণু বা আয়নকে ক্যাটায়ন বলে।
যেমন: \(N{a^ + }\), \(C{a^{ + + }}\) ইত্যাদি
অ্যানায়ন (Anion):
কোনও পরমাণুর সবচেয়ে বাইরের কক্ষপথে ইলেকট্রন গ্রহণের ফলে সৃষ্ট ঋনাত্বক তড়িৎগ্রস্থ পরমাণু বা আয়নকে অ্যানায়ন বলে।
যেমন: \(C{l^ - }\), \({S^ = }\) ইত্যাদি।
নিম্নে কয়েকটি আয়ন তৈরির কৌশলের উদাহরন দেওয়া হল:
(1) \(H - 1e \to {H^ + }\)
(2) \(H + 1e \to {H^ - }\)
(3) \(Li - 1e \to L{i^ + }\)
(4) \(Be - 2e \to B{e^{ + + }}\)
(5) \(B - 3e \to {B^{ + + + }}\)
(6) \(N + 3e \to {N^{ - - - }}\)
(7) \(O + 2e \to {O^{ - - }}\)
(8) \(F + 1e \to {F^ - }\)
(9) \(Na - 1e \to N{a^ + }\)
(10) \(Mg - 2e \to M{g^{ + + }}\)
(11) \(Al - 3e \to A{l^{ + + + }}\)
(12) \(P + 3e \to {P^{ - - - }}\)
(13) \(S + 2e \to {S^{ - - }}\)
(14) \(Cl + 1e \to C{l^ - }\)
(15) \(K - 1e \to {K^ + }\)
(16) \(Ca - 2e \to C{a^{ + + }}\)
Atom & Molecule Part: 1
Atom & Molecule Part: 2
Atom & Molecule Part: 3
Atom & Molecule Part: 4
Atom & Molecule Part: 5
Atom & Molecule Part: 6







No comments:
Post a Comment